EN_version
Il successo dei vaccini Pfizer-BioNTech e Moderna contro il COVID-19 è notevole ed era tutt’altro che garantito. Come abbiamo cercato di spiegare in precedenza, questi due vaccini contengono al loro interno RNA messaggero (mRNA) che è una molecola incredibilmente delicata. Per proteggerla, gli scienziati hanno sfruttato una tecnologia di somministrazione con origini più antiche dell’idea stessa della terapia con mRNA: minuscole “palline”, particelle di lipidi (= grassi) chiamate nanoparticelle lipidiche.
Qui riassumiamo la storia che ha portato all’utilizzo delle nanoparticelle lipidiche in medicina prendendo spunto dall’articolo pubblicato da Chemical & Engineering News, puoi trovare qui l’articolo originale (Copyright © 2021 American Chemical Society).
Le nanoparticelle lipidiche utilizzate nei vaccini anti-COVID-19 contengono solo pochi ingredienti: lipidi, fosfolipidi e colesterolo. Migliaia di questi lipidi incapsulano l’mRNA, lo proteggono dagli enzimi distruttivi e lo trasportano nelle cellule. Per più di 3 decenni, i lipidi sono stati studiati in laboratorio per trasportare molecole/farmaci, ma spesso non sono stati all’altezza delle aspettative quando sono stati testati su animali o esseri umani.
Come e quando sono nate le particelle lipidiche?
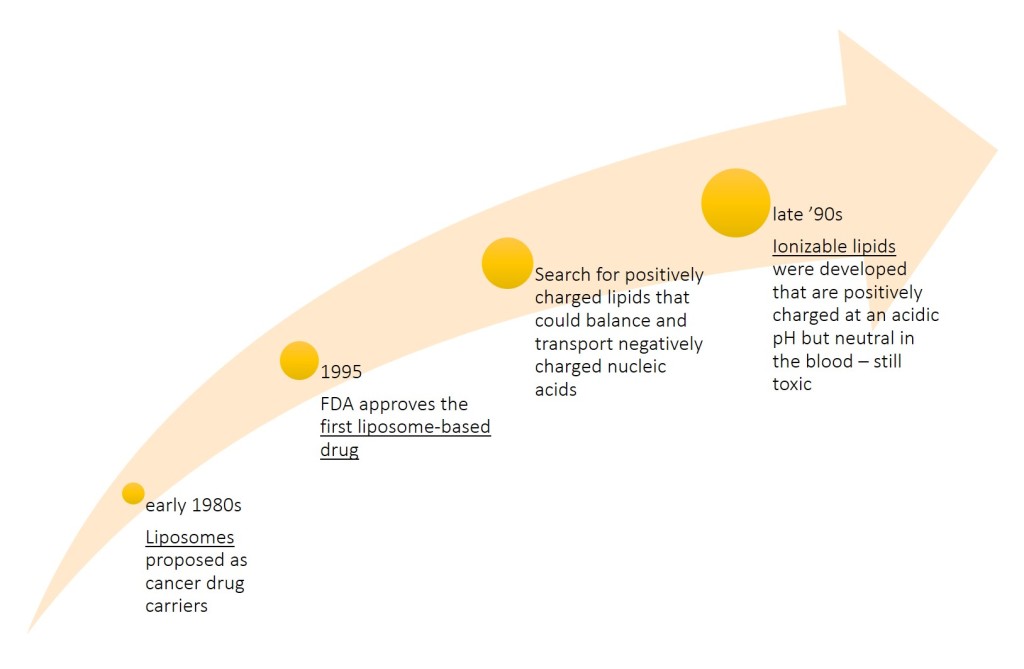
– all’inizio degli anni ’80 i liposomi, sfere lipidiche cave spesso costituite da due o tre tipi di lipidi, furono identificati come portatori di farmaci antitumorali dallo scienziato esperto in nanoparticelle Pieter Cullis (University of British Columbia): i farmaci potevano penetrare in questi liposomi e rimanere intrappolati nel loro nucleo cavo. Una volta iniettati in animali malati di tumore, i liposomi possono viaggiare attraverso il sistema vascolare, penetrare nella zona interessata dal tumore, entrare nelle cellule e liberare il farmaco.
– Il loro progresso e utilizzo è stato rallentato da problemi di stabilità e produzione. Il primo farmaco a base di liposomi fu approvato dalla FDA nel 1995, ma a quel punto Cullis e molti nel campo erano passati a una nuova sfida: usare le particelle lipidiche per trasportare acidi nucleici come DNA e RNA. A quel tempo, gli scienziati erano affascinati dai progressi nella genetica che promettevano di curare le malattie attivando nuovi geni o disattivando i geni che causano malattie.
– Fornire terapie con acidi nucleici – DNA o RNA – nelle cellule rappresentava una sfida importante: per bilanciare gli acidi nucleici caricati negativamente, erano necessari lipidi caricati positivamente, ma non ci sono lipidi cationici in natura e i lipidi caricati positivamente sono tossici e causerebbero la distruzione delle membrane cellulari.
– Durante la fine degli anni ’90 e durante il primo decennio degli anni 2000, una soluzione è stat individuata in nuovi lipidi carichi positivamente solo a determinate condizioni. Cullis, i suoi colleghi di Inex Pharmaceuticals e lo spin-off Inex Protiva Biotherapeutics svilupparono lipidi ionizzabili che sono carichi positivamente a un pH acido, ma neutri nel sangue. Il gruppo creò anche un nuovo modo per produrre nanoparticelle con questi lipidi, utilizzando la microfluidica. Le nanoparticelle lipidiche, a differenza dei liposomi cavi, contenevano lipidi e acidi nucleici impaccati in modo molto fitto. Il processo era semplice in teoria, ma le prime versioni di lipidi ionizzabili erano ancora tossiche e le prime formulazioni delle nanoparticelle tendevano ad accumularsi in alcuni organi dopo ripetute iniezioni.
– Entro il 2005, lo sviluppo di nanoparticelle lipidiche migliori e più sicure è stato guidato dall’entusiasmo per una nuova tecnologia, chiamata small interfering RNA (siRNA), per silenziare selettivamente alcuni geni. Alnylam Pharmaceuticals, che è diventata la principale azienda di siRNA, si è presto resa conto che le nanoparticelle esistenti non erano molto efficaci nel portare siRNA nelle cellule. L’azienda ha stretto quindi numerose partnership per creare nuove nanoparticelle, ma i lipidi che permettevano di produrre nanoparticelle in una piastra Petri, spesso fallivano negli studi sugli animali. Inoltre, alcune delle nanoparticelle lipidiche che funzionavano bene negli animali si sono dimostrate troppo tossiche per una somministrazione ripetuta necesssaria in molte terapie con siRNA.
“Il problema più grande era trovare il giusto equilibrio tra sistemi che fossero efficaci ma anche sicuri e tollerabili”, afferma Marian Gindy, direttore esecutivo delle scienze farmaceutiche di Merck & Co., che ha guidato il team di formulazione dell’RNA dal 2008 fino a quando Merck ha concluso il suo programmi siRNA nel 2013. “E direi che è ancora la sfida più grande in questo settore”.
– Nel 2010, Alnylam aveva ottenuto un lipide ionizzabile vincente noto come MC3. Le nanoparticelle basate su MC3 richiedevano circa un millesimo della dose di nanoparticelle prodotte utilizzando i lipidi ionizzabili più vecchi. Alnylam ha utilizzato la nuova formulazione in patisiran (Onpattro), il suo trattamento per una malattia rara chiamata amiloidosi ereditaria mediata dalla transtiretina.
-Nel 2018, patisiran è diventato il primo farmaco siRNA approvato e la prima terapia approvata che si basa sull’utilizzo di nanoparticelle. Ma il farmaco richiede un’infusione di 80 minuti ogni 3 settimane e un pretrattamento con più farmaci antinfiammatori per ridurre al minimo le reazioni alla nanoparticella. Quando patisiran si è mostrato promettente in clinica, Alnylam aveva messo da parte la maggior parte del suo lavoro sulle nanoparticelle lipidiche a favore di una nuova tecnologia di coniugazione chimica per somministrare siRNA per via sottocutanea.
– Nell’ultimo decennio, lo studio di terapie basate sull’mRNA ha raccolto miliardi di dollari di investimenti. Scoprire come fornire quei filamenti di mRNA nelle cellule è stato un problema sin dal primo giorno, ma l’esperienza precedente con siRNA ha fornito un trampolino di lancio. Dopo aver realizzato che l’MC3 non sarebbe stata la soluzione per veicolare mRNA, Moderna ha investito risorse significative nella costruzione di un lipide ionizzabile migliore. “C’era un gruppo di chimici che si è messo subito al lavoro per costruire nuovi lipidi cationici”, dice Ciaramella, l’ex responsabile delle malattie infettive al Moderna. Il team ha prodotto circa 100 lipidi ionizzabili. Modificando le proporzioni fra i diversi lipidi all’interno delle nanoparticelle, si può indirizzare la distribuzione delle nanoparticelle lipidiche nel corpo.
L’adattabilità è la chiave
Dopo aver ottimizzato la nanoparticella e l’mRNA per raggiungere uno specifico organo, è possibile modificare l’mRNA con modifiche minime per raggiungere altri tessuti. Ad esempio, Moderna ha recentemente realizzato una versione aggiornata del suo vaccino anti-COVID-19 per essere efficace contro una nuova variante del coronavirus identificata per la prima volta in Sud Africa. Ora che l’azienda sa che le sue nanoparticelle funzionano, può utilizzarle più e più volte per diversi vaccini.